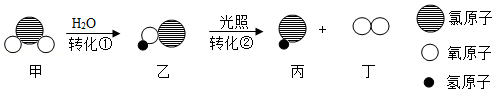
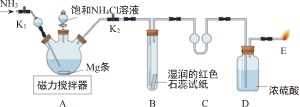
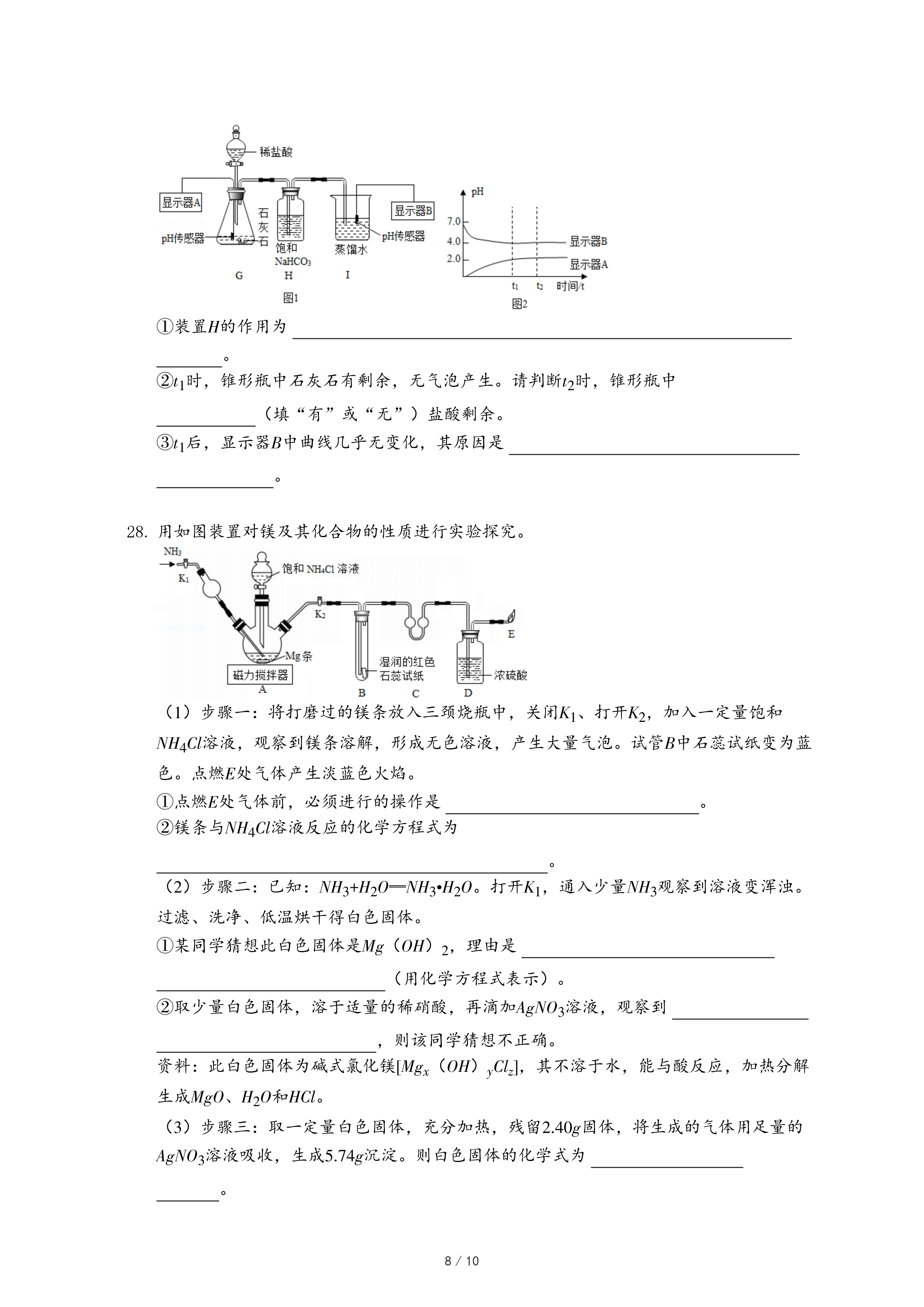
30.铁及其化合物在生产生活中发挥着重要作用。
(一)铁的冶炼和应用
1、我国早在春秋战国时期就开始生产和使用铁器。

(1)深埋的古墓中有些铁器保存至今是因为
(填字母)。
a.铁不活泼
b.密封缺氧
c.干燥少水
(2)胆矾为CuSO
4晶体,《梦溪笔谈》记载“熬胆矾铁釜久亦化为铜”,用化学方程式表示其原理:
。
(3)用赤铁矿高炉炼铁,反应的化学方程式为
。生铁炼钢,主要是降低
元素含量,除去生铁中硅、硫和磷等元素。
(4)硫酸亚铁可作为补铁剂,其药片表面包裹着用淀粉制作的糖衣,淀粉属于
(填“无机物”或“有机物”)。如无此糖衣,FeSO
4暴露在空气中转化成Fe(OH)SO
4而失效,转化的化学方程式为
。
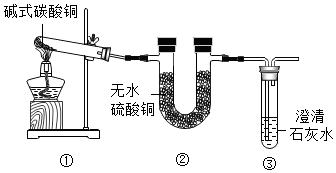
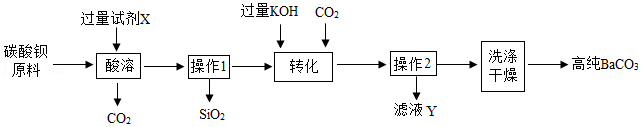
(二)铁红(Fe
2O
3)的制备
用工业烧渣(含有Fe
2O
3、FeO和SiO
2)制备化工原料铁红的实验流程如图2:
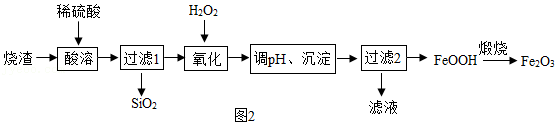
(5)酸溶前将烧渣粉碎,目的是
。写出酸溶时发生的一个化学方程式
。
(6)氧化时发生的反应为2FeSO
4+H
2O
2+H
2SO
4═Fe
2(SO
4)
3+2H
2O反应温度不宜太高,原因是
。
(7)过滤2所得固体必须洗涤,判断固体已经洗净的方法是
。
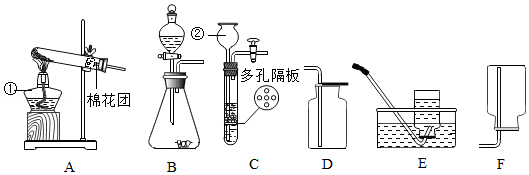
(三)铁触媒的制备
铁触媒是工业合成氨的催化剂,主要成分为Fe
3O
4。用下列装置对铁触媒的制备进行研究。取48.00g铁红置于装置A中,控制不同的温度对其加热,测得装置B和C的质量变化如表。

表:装置B和C的质量变化
| 温度/℃ | 装置B/g | 装置C/g |
| 室温 | 300.00 | 400.00 |
| 550 | 300.45 | 400.55 |
| 600 | 300.90 | 401.10 |
| 650 | 301.80 | 402.20 |
资料:加热到500℃以上,Fe
2O
3和CH
4开始反应,生成铁的其他氧化物、CO
2和H
2O。温度高于700℃,生成Fe。
(8)装配好实验装置后,先要
。
(9)加热前后及过程中均需通入CH
4,加热前通CH
4的目的是
。
(10)加热到650℃时,装置A中剩余固体为FeO和Fe
3O
4的混合物,则两物质的质量比m(FeO):m(Fe
3O
4)=
。
(11)用铁红制取铁触媒,装置A应控制的适宜温度为
℃。



 稀释浓硫酸
稀释浓硫酸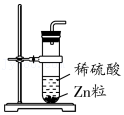 制备H2
制备H2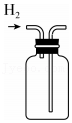 收集H2
收集H2 制得ZnSO4•7H2O
制得ZnSO4•7H2O