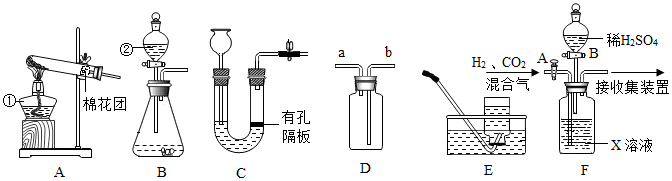
30.铜及其化合物有广泛的应用。
Ⅰ.铜的获得和应用
(1)西汉时期《淮南万毕术》中有“曾青得铁则化为铜”的记载,其中蕴含化学反应的基本类型是
。
(2)我国古代制黄铜的原理如图1。
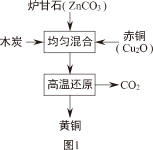
①黄铜的硬度比铜和锌都
(选填“大”或“小”)。
②木炭还原Cu
2O的化学方程式为
。
(3)铜可用于制导线,主要利用了铜的
性。
(4)CuSO
4可配制波尔多液等。向铜粉中加入稀H
2SO
4,通入O
2并加热可得到CuSO
4溶液,反应的化学方程式为
。
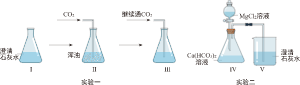
Ⅱ.实验及产物组成测定
如图2为某小组同学所做的实验及现象。
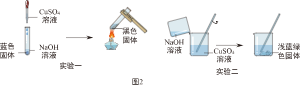
资料:①NaOH和CuSO
4溶液混合可生成Cu(OH)
2、Cu
x(OH)
y(SO
4)
z(铜为+2价)等多种产物。
②68℃时,Cu(OH)
2发生分解;300℃左右,Cu
x(OH)
y(SO
4)
z发生分解,生成铜的氧化物和气体。
(一)实验一中蓝色固体为Cu(OH)
2,则黑色固体是
。
(二)将实验二反应后的物质过滤、洗涤、低温干燥得浅蓝绿色固体样品。小组同学称取27.6g样品,在老师的指导下进行下列实验。
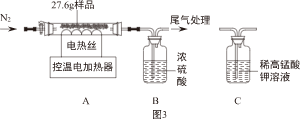
(1)装配好装置后,实验前先要
。
(2)控制温度为68℃,对样品进行热分解至固体质量不再减少,再通一段时间N
2,冷却后测得装置B增重1.8g。则样品中含Cu(OH)
2和Cu
x(OH)
y(SO
4)
z。
①再通一段时间N
2的目的是
②27.6g样品中Cu(OH)
2的质量为
g。
(3)取出装置A中加热后的剩余固体,溶于适量稀盐酸后,再向溶液中加入过量BaCl
2溶液,得11.65g沉淀;继续加入过量NaOH溶液,沉淀质量增加了24.5g。则Cu
x(OH)
y(SO
4)
z中,x:y:z=
。
Ⅲ.样品的热重分析
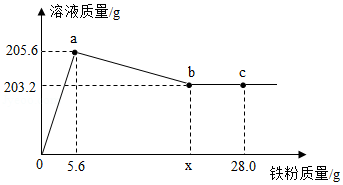
另取27.6g样品,利用图3装置控制温度由低到高加热分解,测得A中剩余固体质量与加热时间的关系如图4。
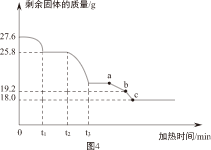
(1)t
1~t
2段固体质量未发生变化的原因是
。
(2)用装置C替代装置B,t
2~t
3段观察到C中溶液褪色,说明样品加热分解时生成了
。
(3)a点为黑色固体。b点固体中铜、氧元素质量比为
。
(4)写出a~c段发生反应的化学方程式:
。




 称量
称量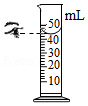 量取
量取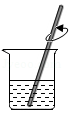 溶解
溶解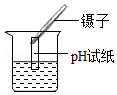 测pH
测pH