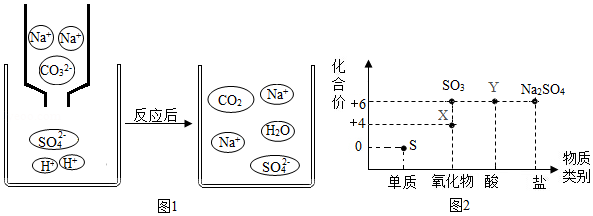
14.铁钉是生活中常见的铁制品。学习小组对不同条件下铁钉的锈蚀和盐酸除锈时的反应进行了探究。
Ⅰ探究不同条件下铁钉的锈蚀
取四枚铁钉,按第图1所示进行实验。一天后观察到的现象如下表所示。
| 试管 | a | b | c | d |
| 实验现象 | 铁钉表面无明显变化 | 铁钉表面无明显变化 | 蒸馏水和空气交界处铁钉出现轻微锈蚀 | 食盐水和空气交界处铁钉出现较多锈蚀 |
(1)由试管a、b、c中的现象可知铁钉锈蚀的条件是
。
(2)由试管c、d中的现象可以得出的结论是
。
(3)切过咸菜的菜刀不及时处理,易生锈。防止切过咸菜的菜刀生锈,处理的方法是
。
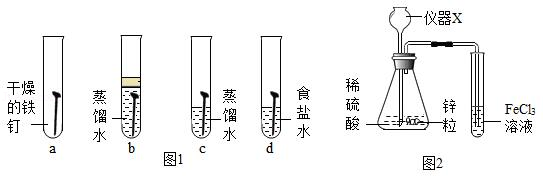
Ⅱ探究盐酸除锈时的反应
步骤1 将一枚表面部分锈蚀的铁钉置于试管中,向其中加入稀盐酸至浸没铁钉。观察到铁钉表面的铁锈逐渐消失,无锈处有气泡产生,溶液变为黄色。
步骤2 将“步骤1”中装有铁钉和盐酸的试管长时间放置后,观察到铁钉变细,溶液变为浅绿色。
【提出问题】①“步骤1”中铁锈消失发生了什么反应?
②“步骤2”中试管长时间放置后,溶液为什么会变色?
【查阅资料】①铁锈中主要含有Fe
2O
3;
②FeCl
3溶液呈黄色,FeCl
2溶液呈浅绿色;
③K
3[Fe(CN)
6]溶液为黄色,FeCl
3溶液遇K
3[Fe(CN)
6]溶液不变色,FeCl
2溶液遇K
3[Fe(CN)
6]溶液会生成蓝色沉淀。
【实验分析】铁锈消失是因为Fe
2O
3与盐酸发生了反应,该反应的化学方程式为
。
【提出猜想】对于问题②,实验小组提出如下两个猜想:
猜想1:溶液变色是FeCl
3与铁钉表面产生的气体反应所致;
猜想2:溶液变色是FeCl
3与铁钉反应所致。
【实验验证1】对“猜想1”进行验证的实验过程用如图2所示装置进行实验,……。
(1)仪器X的名称为
。
(2)实验是验证
(填气体的化学式)与溶液中的FeCl
3是否发生反应。
【实验验证2】请设计实验对“猜想2”进行验证,简述实验过程(包括操作、可能的实验现象和对应的结论):
。(实验中必须用到K
3[Fe(CN)
6]溶液、FeCl
3溶液和铁钉)




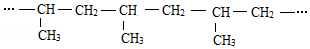
 蒸发食盐水
蒸发食盐水 稀释浓硫酸
稀释浓硫酸 收集氧气
收集氧气 熄灭酒精灯
熄灭酒精灯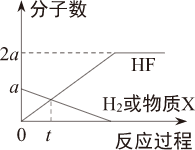
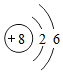 ,硫原子的结构示意图为
,硫原子的结构示意图为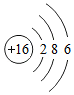 。
。