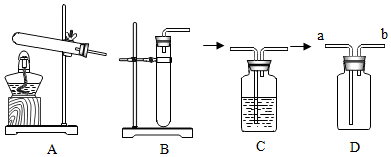
28.石灰石是重要的化工原料。为研究石灰石的性质和用途进行如下探究。
Ⅰ、石灰石分解的探究
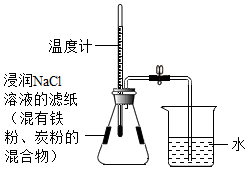
取三块形状大小相近的石灰石(长宽厚约为1cm×1cm×0.2cm),一块不加热,另两块分别在酒精灯和酒精喷灯(酒精化学式为C
2H
5OH)的火焰上加热2min(假设杂质加热时不发生变化)。探究过程如图所示,实验现象见表1。
表1 不同条件下的实验现象
| 实验组别 | 实验条件 | 试管B中的现象 |
| 甲 | 未加热 | 无明显现象 |
| 乙 | 酒精灯加热 | 呈浅红色 |
| 丙 | 酒精喷灯加热 | 呈红色 |
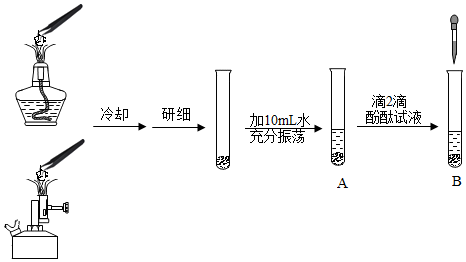
(1)通过甲、乙、丙三组对比实验,得出影响石灰石分解的因素是
。
(2)丙组实验加热石灰石时,在火焰上方倒扣一个用澄清石灰水润湿的烧杯,石灰水变浑浊,出现浑浊的化学方程式为
。此实验能否推断石灰石煅烧产生二氧化碳,并说明理由:
。
(3)丙组实验中,向试管B中逐滴滴入稀盐酸,至红色恰好褪去,轻轻晃动试管,溶液自下而上又变为红色。解释产生上述现象的原因:
。
(4)为检验丙组实验中的石灰石部分分解,设计实验:取研细后的粉末少许于试管中,
(补充完整实验方案)。
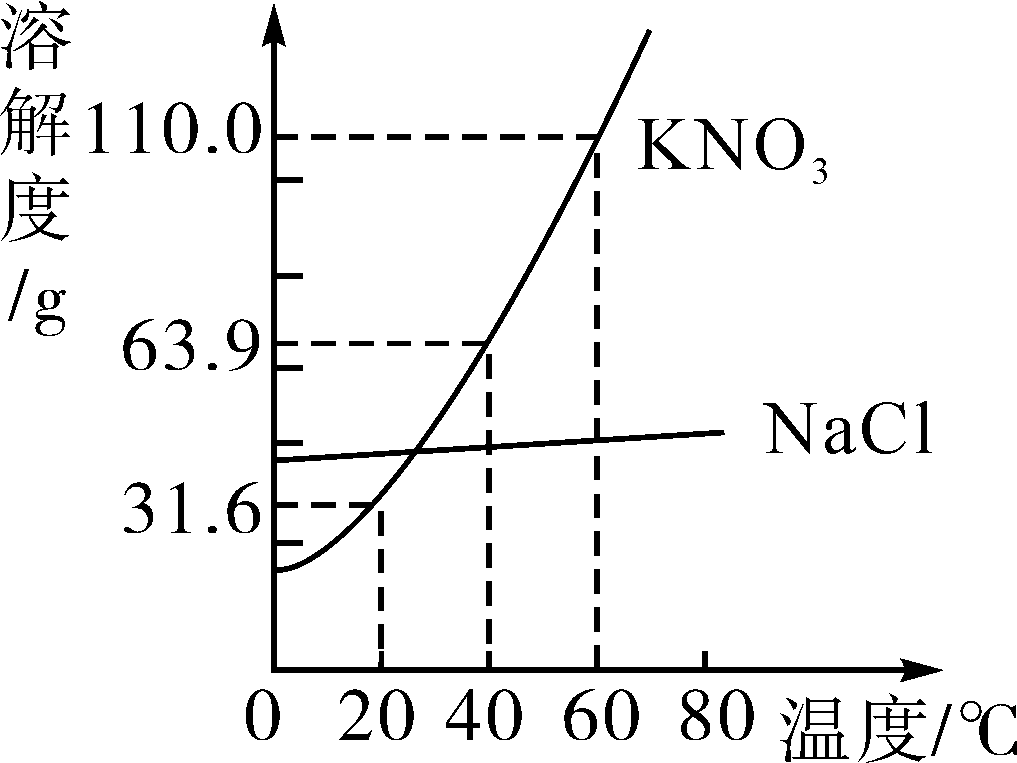
Ⅱ、石灰石煅烧温度的探究
【查阅资料】生石灰质量的优劣常采用“活性度”来衡量。“活性度”的测定方法:取一定质量的生石灰,加入一定量的水,用指定浓度的盐酸中和,记录所消耗盐酸的体积数(单位为mL)。消耗盐酸的体积数越大,“活性度”越高。
某研究小组在电炉内煅烧石灰石样品,并测定煅烧产物(CaO)的活性度,数据见表2。
表2 不同条件下煅烧产物的活性度(mL)
| 煅烧时间/活性度/煅烧温度 | 1050℃ | 1100℃ | 1150℃ | 1200℃ | 1250℃ | 1300℃ |
| 12min | 790 | 836 | 868 | 808 | 454 | 412 |
| 16min | 793 | 856 | 871 | 845 | 556 | 530 |
| 20min | 795 | 863 | 873 | 864 | 617 | 623 |
(5)石灰石煅烧的最佳温度范围为1100~1200℃的证据是
。
Ⅲ、石灰石用途的探究
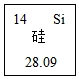
(6)石灰石是高炉炼铁的原料之一。石灰石能除去铁矿石中的SiO
2,同时能提高单位时间内生铁的产率。分析加入石灰石能提高生铁产率的原因:
。




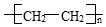 )。聚乙烯属于( )
)。聚乙烯属于( )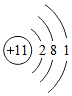
 导管连接
导管连接 胶塞塞紧
胶塞塞紧 气体验满
气体验满 气体收集
气体收集